Estás viendo Inst. Astrobiología NASA
Inst. Astrobiología NASA»Centrales Eléctricas Terrestres
Centrales Eléctricas Terrestres
Publicado por Manuel Hermán Capitán | 26/03/2003
Una curiosa proteína llamada bacteriorodopsina convierte la luz en energía metabólica. Tras 30 años de investigaciones, esta proteína ha revelado finalmente algunos de sus secretos.
Por el personal editorial de Noticias de Astrobiología
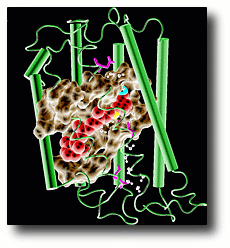 Una curiosa proteína llamada bacteriorodopsina convierte la luz en energía metabólica. Tras 30 años de investigaciones, esta proteína ha revelado finalmente algunos de sus secretos.
Dada la importancia de la chispa eléctrica para toda la vida celular, una extraña proteína, entre otras – llamada bacteriorodopsina – transforma la luz en energía metabólica. Este proceso ha estado siempre rodeado de misterio, pero tras 30 años de investigaciones esta proteína ha revelado algunos de sus secretos. Como informó el boletín del 10 de Agosto de la revista Nature, tres piezas de este puzzle biológico comienzan a encajar.
La bacteriorodopsina es una proteína con un color morado intenso encontrada en microbios que viven en medios ambiente extremos tales como lagunas y pantanos salados. Esta proteína fotosensitiva provee de energía química a estos microbios – a veces llamados Halobacterias. También da a las Halobacterias su característico brillo en colores rojo y morado.
Cuando los nutrientes son escasos, la membrana celular que es rica en bacteriorodopsina entra en acción. Sirven como enzimas fotoconversoras que mantienen en ciclo de vida del organismo en funcionamiento. Específicamente, en respuesta a la luz la bacteriorodopsina bombea protones a través de la membrana, transportando iones cargados dentro y fuera de la célula. De esta forma, la bacteriorodopsina es una central eléctrica de proteína que se conecta en tiempos de escasez, cambiando el color de morado a amarillo cuando está absorbiendo luz.
Tal y como resalta el artículo de Nature, esta función de la bacteriorodopsina se puede comprender mejor analizando su estructura atómica. Este tipo de análisis ha mostrado que cuando la bacteriorodopsina absorbe un fotón de luz, esta pasa a través de un ciclo de cambios estructurales. Cada cambio en la estructura molecular es llamado “intermedio”.
Es sabido desde hace tiempo que la bacteriorodopsina atraviesa distintos intermedios durante el ciclo de bombeo de protones. Estas fases han sido marcadas como K, L, M, N, y O cada una de ellas fácilmente identificable debido a que la bacteriorodopsina cambia de color en cada fase del proceso.
En cambio la transición entre las fases no ha sido fácil de estudiar. Las proteínas de membrana como la bacteriorodopsina no se comportan de forma predecible en soluciones acuosas (algunas como aceite y agua mezcladas) y de este modo no pueden ser estudiados en transición o como fotogramas estáticos.
Par estudiar algo tan pequeño como moléculas de proteina, los científicos usan normalmente la difracción de rayos X. Cristalizar las líneas de proteínas colocándolas en una matriz regular. El cristal es entonces colocado en un chorro de rayos X. Esto produce un patrón difuso que muestra un dibujo de la proteína. El dibujo es similar a una sombra proyectada a través de un vallado – el contorno de la sombra indica que el bloque estructural básico de la valla es un tablero rectangular. Pasando los rayos X a través de un cristal de proteína indica la forma de la proteína, donde está localizada, y finalmente como quizás trabaje.
Sin embargo, la estructura cristalina de la bacteriorodopsina no ha sido fácil de obtener. No sólo es en general difícil de cristalizar proteínas de la membrana, sino que a la bacteriorodopsina no le gusta ser atrapada en estos estados inestables intermedios. Estas dificultades técnicas solo han podido ser superadas a lo largo del último año. La proteína fue cristalizada en órbita a bordo de la lanzadera espacial por un grupo de científicos de la Universidad Justus-Liebig de Glessen, Alemania y el Instituto de Química Fisiológica de Hamburgo. Las condiciones de microgravedad de la órbita espacial mejoraron el proceso del crecimiento del cristal para proteínas de membrana con dificultades como la bacteriorodopsina. La forma cúbica de los cristales espaciales muestran un volumen 20 veces mayor comparados con su homólogo generado en la tierra. El gran volumen de los cristales generados en el espacio ayudará a los científicos a leer el cianotipo de la proteína y entender su funcionamiento.
Los datos publicados por distintos laboratorios están de acuerdo: La luz recibida es convertida en algún tipo de carga eléctrica o diferencia alcalino-ácida (pH) entre el interior y el exterior de la membrana de una célula viva.
La mayoría de vida biológica depende de este tipo de mecanismos para el transporte de iones, neurotransmisores, encimas, residuos y otras biomoléculas. Gran parte de la vida en sí misma está íntimamente ligada al éxito y eficacia de la transformación de luz, directamente como en la fotosíntesis o indirectamente a través de procesos químicos como en la digestión.
El estudio de la bacteriorodopsina nos ayuda a comprender mejor a las primeras formas de vida microbianas conocidas como Archaea (arqueobacterias). Estos organismos viven en algunos de los más extremos medios ambientes de La Tierra, afrontando agua hirviendo, alcalinos, ácido, o aguas muy saladas, terrenos de alta radiación y metales pesados. Las arqueobacterias, sin embargo, no están restringidas solo a entornos extremos, también podemos encontrarlas de formas abundante en el plancton del mar abierto. Estudiando tales técnicas de supervivencia podríamos ayudar a los investigadores a producir nuevas teorías sobre la evolución en la tierra, y quizá también en otros planetas.
¿Qué es lo siguiente?
La bacteriorodopsina ha atraído la atención de científicos interesados en el uso de materiales biológicos que lleven a cabo funciones tecnológicas. Parte de la atracción de los materiales naturales es que muchos llevan a cabo funciones muy complejas que no pueden ser fácilmente sintetizadas. La evolución ha perfeccionado estas funciones a lo largo de mil millones de años, llevándolas a cabo mucho mejor de lo que los materiales diseñados por el hombre nunca podrían.
En los últimos 25 años, la bacteriorodopsina ha suscitado un gran interés entre bioquímicos, biofísicos y mas recientemente entre compañías que buscan construir baterías de larga duración. En caso de ser controlables, las proteínas de cambio rápido como la bacteriorodopsina podría ser también usada en algún tipo de escritura electrónica.
Además de esto, las propiedades fotoeléctricas de las proteínas podrían ser usadas para fabricar fotodetectores. La bacteriorodopsina es también un material atractivo para ordenadores portátiles de funcionamiento con luz debido a las dos formas estables de la proteína, una morada y otra amarilla.
Iluminando con dos lásers de distinta longitud de onda alternativamente sobre la proteína intercambiamos ambos colores. Algunos grupos de investigación han usado ya bacteriorodopsina como memoria de ordenador y como elemento fotosensitivo en retinas artificiales.
Investigador Principal: Torsten Rothaemel, Gottgried Wagner, Universidad Justus-Liebig, Departamento de Biología, Senckenbergstrasse 17, 35390 Giessen, Alemania.
Co-investigadores: Christian Betzel, Markus Perbandt, Instituto de Química Fisiológica, c/o DESY, Geb. 22a, Notkestrasse 85, 22603 Hamburgo, Alemania.
Una curiosa proteína llamada bacteriorodopsina convierte la luz en energía metabólica. Tras 30 años de investigaciones, esta proteína ha revelado finalmente algunos de sus secretos.
Dada la importancia de la chispa eléctrica para toda la vida celular, una extraña proteína, entre otras – llamada bacteriorodopsina – transforma la luz en energía metabólica. Este proceso ha estado siempre rodeado de misterio, pero tras 30 años de investigaciones esta proteína ha revelado algunos de sus secretos. Como informó el boletín del 10 de Agosto de la revista Nature, tres piezas de este puzzle biológico comienzan a encajar.
La bacteriorodopsina es una proteína con un color morado intenso encontrada en microbios que viven en medios ambiente extremos tales como lagunas y pantanos salados. Esta proteína fotosensitiva provee de energía química a estos microbios – a veces llamados Halobacterias. También da a las Halobacterias su característico brillo en colores rojo y morado.
Cuando los nutrientes son escasos, la membrana celular que es rica en bacteriorodopsina entra en acción. Sirven como enzimas fotoconversoras que mantienen en ciclo de vida del organismo en funcionamiento. Específicamente, en respuesta a la luz la bacteriorodopsina bombea protones a través de la membrana, transportando iones cargados dentro y fuera de la célula. De esta forma, la bacteriorodopsina es una central eléctrica de proteína que se conecta en tiempos de escasez, cambiando el color de morado a amarillo cuando está absorbiendo luz.
Tal y como resalta el artículo de Nature, esta función de la bacteriorodopsina se puede comprender mejor analizando su estructura atómica. Este tipo de análisis ha mostrado que cuando la bacteriorodopsina absorbe un fotón de luz, esta pasa a través de un ciclo de cambios estructurales. Cada cambio en la estructura molecular es llamado “intermedio”.
Es sabido desde hace tiempo que la bacteriorodopsina atraviesa distintos intermedios durante el ciclo de bombeo de protones. Estas fases han sido marcadas como K, L, M, N, y O cada una de ellas fácilmente identificable debido a que la bacteriorodopsina cambia de color en cada fase del proceso.
En cambio la transición entre las fases no ha sido fácil de estudiar. Las proteínas de membrana como la bacteriorodopsina no se comportan de forma predecible en soluciones acuosas (algunas como aceite y agua mezcladas) y de este modo no pueden ser estudiados en transición o como fotogramas estáticos.
Par estudiar algo tan pequeño como moléculas de proteina, los científicos usan normalmente la difracción de rayos X. Cristalizar las líneas de proteínas colocándolas en una matriz regular. El cristal es entonces colocado en un chorro de rayos X. Esto produce un patrón difuso que muestra un dibujo de la proteína. El dibujo es similar a una sombra proyectada a través de un vallado – el contorno de la sombra indica que el bloque estructural básico de la valla es un tablero rectangular. Pasando los rayos X a través de un cristal de proteína indica la forma de la proteína, donde está localizada, y finalmente como quizás trabaje.
Sin embargo, la estructura cristalina de la bacteriorodopsina no ha sido fácil de obtener. No sólo es en general difícil de cristalizar proteínas de la membrana, sino que a la bacteriorodopsina no le gusta ser atrapada en estos estados inestables intermedios. Estas dificultades técnicas solo han podido ser superadas a lo largo del último año. La proteína fue cristalizada en órbita a bordo de la lanzadera espacial por un grupo de científicos de la Universidad Justus-Liebig de Glessen, Alemania y el Instituto de Química Fisiológica de Hamburgo. Las condiciones de microgravedad de la órbita espacial mejoraron el proceso del crecimiento del cristal para proteínas de membrana con dificultades como la bacteriorodopsina. La forma cúbica de los cristales espaciales muestran un volumen 20 veces mayor comparados con su homólogo generado en la tierra. El gran volumen de los cristales generados en el espacio ayudará a los científicos a leer el cianotipo de la proteína y entender su funcionamiento.
Los datos publicados por distintos laboratorios están de acuerdo: La luz recibida es convertida en algún tipo de carga eléctrica o diferencia alcalino-ácida (pH) entre el interior y el exterior de la membrana de una célula viva.
La mayoría de vida biológica depende de este tipo de mecanismos para el transporte de iones, neurotransmisores, encimas, residuos y otras biomoléculas. Gran parte de la vida en sí misma está íntimamente ligada al éxito y eficacia de la transformación de luz, directamente como en la fotosíntesis o indirectamente a través de procesos químicos como en la digestión.
El estudio de la bacteriorodopsina nos ayuda a comprender mejor a las primeras formas de vida microbianas conocidas como Archaea (arqueobacterias). Estos organismos viven en algunos de los más extremos medios ambientes de La Tierra, afrontando agua hirviendo, alcalinos, ácido, o aguas muy saladas, terrenos de alta radiación y metales pesados. Las arqueobacterias, sin embargo, no están restringidas solo a entornos extremos, también podemos encontrarlas de formas abundante en el plancton del mar abierto. Estudiando tales técnicas de supervivencia podríamos ayudar a los investigadores a producir nuevas teorías sobre la evolución en la tierra, y quizá también en otros planetas.
¿Qué es lo siguiente?
La bacteriorodopsina ha atraído la atención de científicos interesados en el uso de materiales biológicos que lleven a cabo funciones tecnológicas. Parte de la atracción de los materiales naturales es que muchos llevan a cabo funciones muy complejas que no pueden ser fácilmente sintetizadas. La evolución ha perfeccionado estas funciones a lo largo de mil millones de años, llevándolas a cabo mucho mejor de lo que los materiales diseñados por el hombre nunca podrían.
En los últimos 25 años, la bacteriorodopsina ha suscitado un gran interés entre bioquímicos, biofísicos y mas recientemente entre compañías que buscan construir baterías de larga duración. En caso de ser controlables, las proteínas de cambio rápido como la bacteriorodopsina podría ser también usada en algún tipo de escritura electrónica.
Además de esto, las propiedades fotoeléctricas de las proteínas podrían ser usadas para fabricar fotodetectores. La bacteriorodopsina es también un material atractivo para ordenadores portátiles de funcionamiento con luz debido a las dos formas estables de la proteína, una morada y otra amarilla.
Iluminando con dos lásers de distinta longitud de onda alternativamente sobre la proteína intercambiamos ambos colores. Algunos grupos de investigación han usado ya bacteriorodopsina como memoria de ordenador y como elemento fotosensitivo en retinas artificiales.
Investigador Principal: Torsten Rothaemel, Gottgried Wagner, Universidad Justus-Liebig, Departamento de Biología, Senckenbergstrasse 17, 35390 Giessen, Alemania.
Co-investigadores: Christian Betzel, Markus Perbandt, Instituto de Química Fisiológica, c/o DESY, Geb. 22a, Notkestrasse 85, 22603 Hamburgo, Alemania.
http://nai.arc.nasa.gov/news_stories/news_detail.cfm?ID=216
 Una curiosa proteína llamada bacteriorodopsina convierte la luz en energía metabólica. Tras 30 años de investigaciones, esta proteína ha revelado finalmente algunos de sus secretos.
Dada la importancia de la chispa eléctrica para toda la vida celular, una extraña proteína, entre otras – llamada bacteriorodopsina – transforma la luz en energía metabólica. Este proceso ha estado siempre rodeado de misterio, pero tras 30 años de investigaciones esta proteína ha revelado algunos de sus secretos. Como informó el boletín del 10 de Agosto de la revista Nature, tres piezas de este puzzle biológico comienzan a encajar.
La bacteriorodopsina es una proteína con un color morado intenso encontrada en microbios que viven en medios ambiente extremos tales como lagunas y pantanos salados. Esta proteína fotosensitiva provee de energía química a estos microbios – a veces llamados Halobacterias. También da a las Halobacterias su característico brillo en colores rojo y morado.
Cuando los nutrientes son escasos, la membrana celular que es rica en bacteriorodopsina entra en acción. Sirven como enzimas fotoconversoras que mantienen en ciclo de vida del organismo en funcionamiento. Específicamente, en respuesta a la luz la bacteriorodopsina bombea protones a través de la membrana, transportando iones cargados dentro y fuera de la célula. De esta forma, la bacteriorodopsina es una central eléctrica de proteína que se conecta en tiempos de escasez, cambiando el color de morado a amarillo cuando está absorbiendo luz.
Tal y como resalta el artículo de Nature, esta función de la bacteriorodopsina se puede comprender mejor analizando su estructura atómica. Este tipo de análisis ha mostrado que cuando la bacteriorodopsina absorbe un fotón de luz, esta pasa a través de un ciclo de cambios estructurales. Cada cambio en la estructura molecular es llamado “intermedio”.
Es sabido desde hace tiempo que la bacteriorodopsina atraviesa distintos intermedios durante el ciclo de bombeo de protones. Estas fases han sido marcadas como K, L, M, N, y O cada una de ellas fácilmente identificable debido a que la bacteriorodopsina cambia de color en cada fase del proceso.
En cambio la transición entre las fases no ha sido fácil de estudiar. Las proteínas de membrana como la bacteriorodopsina no se comportan de forma predecible en soluciones acuosas (algunas como aceite y agua mezcladas) y de este modo no pueden ser estudiados en transición o como fotogramas estáticos.
Par estudiar algo tan pequeño como moléculas de proteina, los científicos usan normalmente la difracción de rayos X. Cristalizar las líneas de proteínas colocándolas en una matriz regular. El cristal es entonces colocado en un chorro de rayos X. Esto produce un patrón difuso que muestra un dibujo de la proteína. El dibujo es similar a una sombra proyectada a través de un vallado – el contorno de la sombra indica que el bloque estructural básico de la valla es un tablero rectangular. Pasando los rayos X a través de un cristal de proteína indica la forma de la proteína, donde está localizada, y finalmente como quizás trabaje.
Sin embargo, la estructura cristalina de la bacteriorodopsina no ha sido fácil de obtener. No sólo es en general difícil de cristalizar proteínas de la membrana, sino que a la bacteriorodopsina no le gusta ser atrapada en estos estados inestables intermedios. Estas dificultades técnicas solo han podido ser superadas a lo largo del último año. La proteína fue cristalizada en órbita a bordo de la lanzadera espacial por un grupo de científicos de la Universidad Justus-Liebig de Glessen, Alemania y el Instituto de Química Fisiológica de Hamburgo. Las condiciones de microgravedad de la órbita espacial mejoraron el proceso del crecimiento del cristal para proteínas de membrana con dificultades como la bacteriorodopsina. La forma cúbica de los cristales espaciales muestran un volumen 20 veces mayor comparados con su homólogo generado en la tierra. El gran volumen de los cristales generados en el espacio ayudará a los científicos a leer el cianotipo de la proteína y entender su funcionamiento.
Los datos publicados por distintos laboratorios están de acuerdo: La luz recibida es convertida en algún tipo de carga eléctrica o diferencia alcalino-ácida (pH) entre el interior y el exterior de la membrana de una célula viva.
La mayoría de vida biológica depende de este tipo de mecanismos para el transporte de iones, neurotransmisores, encimas, residuos y otras biomoléculas. Gran parte de la vida en sí misma está íntimamente ligada al éxito y eficacia de la transformación de luz, directamente como en la fotosíntesis o indirectamente a través de procesos químicos como en la digestión.
El estudio de la bacteriorodopsina nos ayuda a comprender mejor a las primeras formas de vida microbianas conocidas como Archaea (arqueobacterias). Estos organismos viven en algunos de los más extremos medios ambientes de La Tierra, afrontando agua hirviendo, alcalinos, ácido, o aguas muy saladas, terrenos de alta radiación y metales pesados. Las arqueobacterias, sin embargo, no están restringidas solo a entornos extremos, también podemos encontrarlas de formas abundante en el plancton del mar abierto. Estudiando tales técnicas de supervivencia podríamos ayudar a los investigadores a producir nuevas teorías sobre la evolución en la tierra, y quizá también en otros planetas.
¿Qué es lo siguiente?
La bacteriorodopsina ha atraído la atención de científicos interesados en el uso de materiales biológicos que lleven a cabo funciones tecnológicas. Parte de la atracción de los materiales naturales es que muchos llevan a cabo funciones muy complejas que no pueden ser fácilmente sintetizadas. La evolución ha perfeccionado estas funciones a lo largo de mil millones de años, llevándolas a cabo mucho mejor de lo que los materiales diseñados por el hombre nunca podrían.
En los últimos 25 años, la bacteriorodopsina ha suscitado un gran interés entre bioquímicos, biofísicos y mas recientemente entre compañías que buscan construir baterías de larga duración. En caso de ser controlables, las proteínas de cambio rápido como la bacteriorodopsina podría ser también usada en algún tipo de escritura electrónica.
Además de esto, las propiedades fotoeléctricas de las proteínas podrían ser usadas para fabricar fotodetectores. La bacteriorodopsina es también un material atractivo para ordenadores portátiles de funcionamiento con luz debido a las dos formas estables de la proteína, una morada y otra amarilla.
Iluminando con dos lásers de distinta longitud de onda alternativamente sobre la proteína intercambiamos ambos colores. Algunos grupos de investigación han usado ya bacteriorodopsina como memoria de ordenador y como elemento fotosensitivo en retinas artificiales.
Investigador Principal: Torsten Rothaemel, Gottgried Wagner, Universidad Justus-Liebig, Departamento de Biología, Senckenbergstrasse 17, 35390 Giessen, Alemania.
Co-investigadores: Christian Betzel, Markus Perbandt, Instituto de Química Fisiológica, c/o DESY, Geb. 22a, Notkestrasse 85, 22603 Hamburgo, Alemania.
Una curiosa proteína llamada bacteriorodopsina convierte la luz en energía metabólica. Tras 30 años de investigaciones, esta proteína ha revelado finalmente algunos de sus secretos.
Dada la importancia de la chispa eléctrica para toda la vida celular, una extraña proteína, entre otras – llamada bacteriorodopsina – transforma la luz en energía metabólica. Este proceso ha estado siempre rodeado de misterio, pero tras 30 años de investigaciones esta proteína ha revelado algunos de sus secretos. Como informó el boletín del 10 de Agosto de la revista Nature, tres piezas de este puzzle biológico comienzan a encajar.
La bacteriorodopsina es una proteína con un color morado intenso encontrada en microbios que viven en medios ambiente extremos tales como lagunas y pantanos salados. Esta proteína fotosensitiva provee de energía química a estos microbios – a veces llamados Halobacterias. También da a las Halobacterias su característico brillo en colores rojo y morado.
Cuando los nutrientes son escasos, la membrana celular que es rica en bacteriorodopsina entra en acción. Sirven como enzimas fotoconversoras que mantienen en ciclo de vida del organismo en funcionamiento. Específicamente, en respuesta a la luz la bacteriorodopsina bombea protones a través de la membrana, transportando iones cargados dentro y fuera de la célula. De esta forma, la bacteriorodopsina es una central eléctrica de proteína que se conecta en tiempos de escasez, cambiando el color de morado a amarillo cuando está absorbiendo luz.
Tal y como resalta el artículo de Nature, esta función de la bacteriorodopsina se puede comprender mejor analizando su estructura atómica. Este tipo de análisis ha mostrado que cuando la bacteriorodopsina absorbe un fotón de luz, esta pasa a través de un ciclo de cambios estructurales. Cada cambio en la estructura molecular es llamado “intermedio”.
Es sabido desde hace tiempo que la bacteriorodopsina atraviesa distintos intermedios durante el ciclo de bombeo de protones. Estas fases han sido marcadas como K, L, M, N, y O cada una de ellas fácilmente identificable debido a que la bacteriorodopsina cambia de color en cada fase del proceso.
En cambio la transición entre las fases no ha sido fácil de estudiar. Las proteínas de membrana como la bacteriorodopsina no se comportan de forma predecible en soluciones acuosas (algunas como aceite y agua mezcladas) y de este modo no pueden ser estudiados en transición o como fotogramas estáticos.
Par estudiar algo tan pequeño como moléculas de proteina, los científicos usan normalmente la difracción de rayos X. Cristalizar las líneas de proteínas colocándolas en una matriz regular. El cristal es entonces colocado en un chorro de rayos X. Esto produce un patrón difuso que muestra un dibujo de la proteína. El dibujo es similar a una sombra proyectada a través de un vallado – el contorno de la sombra indica que el bloque estructural básico de la valla es un tablero rectangular. Pasando los rayos X a través de un cristal de proteína indica la forma de la proteína, donde está localizada, y finalmente como quizás trabaje.
Sin embargo, la estructura cristalina de la bacteriorodopsina no ha sido fácil de obtener. No sólo es en general difícil de cristalizar proteínas de la membrana, sino que a la bacteriorodopsina no le gusta ser atrapada en estos estados inestables intermedios. Estas dificultades técnicas solo han podido ser superadas a lo largo del último año. La proteína fue cristalizada en órbita a bordo de la lanzadera espacial por un grupo de científicos de la Universidad Justus-Liebig de Glessen, Alemania y el Instituto de Química Fisiológica de Hamburgo. Las condiciones de microgravedad de la órbita espacial mejoraron el proceso del crecimiento del cristal para proteínas de membrana con dificultades como la bacteriorodopsina. La forma cúbica de los cristales espaciales muestran un volumen 20 veces mayor comparados con su homólogo generado en la tierra. El gran volumen de los cristales generados en el espacio ayudará a los científicos a leer el cianotipo de la proteína y entender su funcionamiento.
Los datos publicados por distintos laboratorios están de acuerdo: La luz recibida es convertida en algún tipo de carga eléctrica o diferencia alcalino-ácida (pH) entre el interior y el exterior de la membrana de una célula viva.
La mayoría de vida biológica depende de este tipo de mecanismos para el transporte de iones, neurotransmisores, encimas, residuos y otras biomoléculas. Gran parte de la vida en sí misma está íntimamente ligada al éxito y eficacia de la transformación de luz, directamente como en la fotosíntesis o indirectamente a través de procesos químicos como en la digestión.
El estudio de la bacteriorodopsina nos ayuda a comprender mejor a las primeras formas de vida microbianas conocidas como Archaea (arqueobacterias). Estos organismos viven en algunos de los más extremos medios ambientes de La Tierra, afrontando agua hirviendo, alcalinos, ácido, o aguas muy saladas, terrenos de alta radiación y metales pesados. Las arqueobacterias, sin embargo, no están restringidas solo a entornos extremos, también podemos encontrarlas de formas abundante en el plancton del mar abierto. Estudiando tales técnicas de supervivencia podríamos ayudar a los investigadores a producir nuevas teorías sobre la evolución en la tierra, y quizá también en otros planetas.
¿Qué es lo siguiente?
La bacteriorodopsina ha atraído la atención de científicos interesados en el uso de materiales biológicos que lleven a cabo funciones tecnológicas. Parte de la atracción de los materiales naturales es que muchos llevan a cabo funciones muy complejas que no pueden ser fácilmente sintetizadas. La evolución ha perfeccionado estas funciones a lo largo de mil millones de años, llevándolas a cabo mucho mejor de lo que los materiales diseñados por el hombre nunca podrían.
En los últimos 25 años, la bacteriorodopsina ha suscitado un gran interés entre bioquímicos, biofísicos y mas recientemente entre compañías que buscan construir baterías de larga duración. En caso de ser controlables, las proteínas de cambio rápido como la bacteriorodopsina podría ser también usada en algún tipo de escritura electrónica.
Además de esto, las propiedades fotoeléctricas de las proteínas podrían ser usadas para fabricar fotodetectores. La bacteriorodopsina es también un material atractivo para ordenadores portátiles de funcionamiento con luz debido a las dos formas estables de la proteína, una morada y otra amarilla.
Iluminando con dos lásers de distinta longitud de onda alternativamente sobre la proteína intercambiamos ambos colores. Algunos grupos de investigación han usado ya bacteriorodopsina como memoria de ordenador y como elemento fotosensitivo en retinas artificiales.
Investigador Principal: Torsten Rothaemel, Gottgried Wagner, Universidad Justus-Liebig, Departamento de Biología, Senckenbergstrasse 17, 35390 Giessen, Alemania.
Co-investigadores: Christian Betzel, Markus Perbandt, Instituto de Química Fisiológica, c/o DESY, Geb. 22a, Notkestrasse 85, 22603 Hamburgo, Alemania.
x Comentarios
- Twittear
Desde el foro
- » ¿CÓMO SE HABRÍA DESARROLLADO LA RELATIVIDAD SIN EINSTEIN?Por José Luis Valer | 23 comentarios
- » Viajes a MartePor aregidor | 208 comentarios
- » Naves espaciales nucleares: Si o NoPor aregidor | 89 comentarios
- » Números reales consecutivosPor aregidor | 4 comentarios
- » Multiverso a la vistaPor chico26 | 20 comentarios
- » Pelis de CFPor Robert H | 232 comentarios
- » Velocidad relativa entre galaxiasPor Jaime Rudas | 40 comentarios
- » ¿Es difícil Grado en Matemáticas para un mayor de 34 años?Por CARMEN93 | 11 comentarios
- » Antes o mas alla del BB.Por ANTUAN DU CHAMP | 4 comentarios
- » LRO en la lunaPor pochimax | 19 comentarios
Facebook
Twitter

Comentarios